通常では送達できない部位に、薬物を送り込む。
この記事には広告が含まれています。
バブル製剤と超音波
マイクロバブルという製剤があります。国内では第一三共から発売されている「ソナゾイド」という薬剤が該当します。
現在の適応は「超音波検査における肝腫瘤性病変と乳房腫瘤性病変の造影」とされているように、本来の使用目的は超音波造影剤です。
ソナゾイドは、脂質膜の中にパーフルオロブタン(C4F10)という超音波造影ガスが封入されています。ガスのままだと血流に乗せて送達させることができないので、脂質膜に包んで運びやすくしたものです。イメージとしては「割れにくいシャボン玉」かな。
造影剤なので、超音波エコー検査に用いられる低強度の超音波が照射されると、ガスの部分が白く写ります。胎児の検査をイメージしてもらえればいいと思いますが、そんな感じの像が見えます。
しかし、照射する超音波の強度を高くすると(それでも生体にほとんど影響はないレベル)、マイクロバブルが「キャビテーション」という動きをします。
キャビテーションを発生させる
ソナゾイドの場合は「パーフルオロブタン(C4F10)」というガスが封入されていますが、その他にも「パーフルオロプロパン(C3F8)」も超音波応答性ガスとして知られています。
このようなガスを脂質膜中に封入したバブル製剤に対して、エコーよりも強い超音波を照射すると「キャビテーション」という動きをします。
つまり、超音波からエネルギーを受け、1秒間に十数回という早い周期(これは超音波の周波数に依存します)でバブル製剤が拡張・収縮と繰り返したり、または破裂したりします。前者を「Stable Cavitation」、後者を「Inertial Cavitation」と呼びます。(Dasgupta A. et al. Drug Discov Today Technol. 2016; 20:41–48 PubMed)
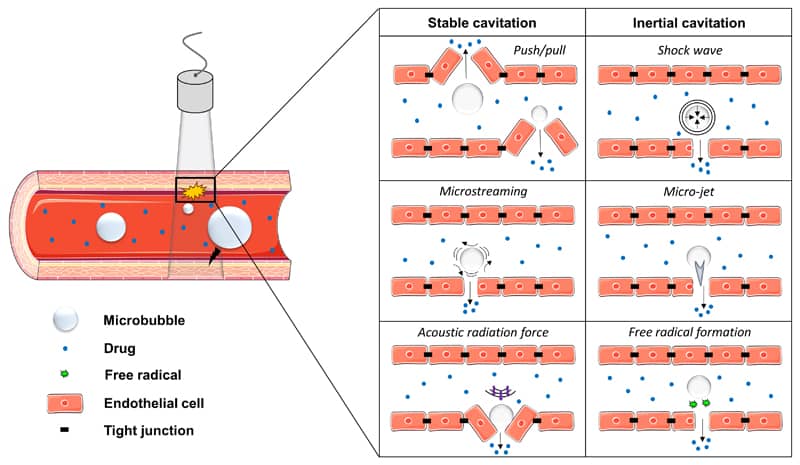
この「キャビテーション」というエネルギーを使って一過性に穴を開け、そこから薬物を送達するというのが超音波応答性DDSのコンセプトです。
超音波応答性DDSを用いた薬物送達
バブル製剤を血管内に投与した上で、薬物を送達させたい部分の皮膚の上から超音波を照射すると、その部分のバブル製剤がキャビテーションを引き起こし、血管内皮細胞同士の結合が弱まり、血管透過性が亢進します。
このときにバブル製剤と薬物を同時に投与しておくと、薬物が血管を越えて組織側へと移行します。たとえば、脳の毛細血管内皮細胞同士の密着結合である血液脳関門(BBB)の透過性も亢進させることができ、現在は実用化を見据えた臨床試験がフランスなどで進んでいます(Carpentier A et al. Sci Transl Med, 2016;8:343re2. PubMed)。
また、細胞同士の結合だけでなく、細胞自体にも一過性の小孔を開けることができます。このことを「ソノポレーション」とよび、治療タンパク質を産生する遺伝子を細胞内に導入することが可能です。いわゆる遺伝子治療というやつですね。
最近だと、マウスの腹膜にプラスミドDNAを導入した報告がアクセプトされています(Nishimura K. et al. Pharmaceutics. 2019;11(5):244. Pubmed)。まあ、この図はほぼ僕が描いたわけですが。
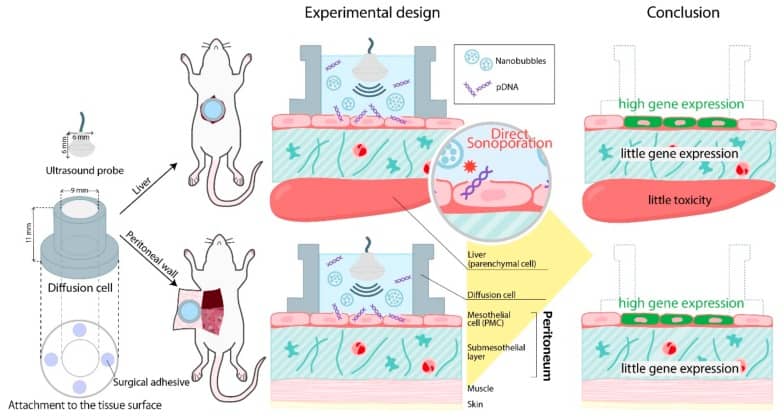
まとめ
このような感じで、バブル製剤と超音波照射を組み合わせることで、通常では送達できない部位に対して能動的に薬物を送り込むことができます。さらに、超音波照射部位は照射する人の手でコントロールできるので、限局したターゲティングを行うことも可能です。
DDSの技術が進歩すると、既存の薬剤の利用可能性を広げることができると考えられます。ひとつの送達法が実用化されるとさまざまな疾患に対して応用できるものなので、新たな薬剤を開発するよりもインパクトが大きいかもしれません。
特に、脳疾患はBBBの存在によって薬物を送達できなくてアンメットメディカルニーズが大きいという側面もあるので、このようなDDS技術の発展を待ち望んでいる患者さんはたくさんいるはず。
フランスなどで臨床試験も行われるほどなので、決して夢物語ではないと思っています。安全性の懸念はありますが、近い将来に実用化されるかな、と思います。









